Атомарный ксенон какой спектр
Опубликовано: 17.05.2024
Для лучшего понимания как светят различные автомобильные источники света собрал здесь информацию о спектрах излучения.
Для начала спектр солнца:
Вот так видят наши глаза солнечный свет, благодаря Дарвину и милионам лет, сформировавшим наше зрение. Запомните что человеческий глаз имеет наибольшую чувствительность в районе 555нм (зелёный цвет).
Галогеновый источник излучает в видимом спектре со сдвигом в красную и инфракрасную сторону (отдаёт теплом):
Ксеноновая лампа даёт дискретный спектр и бесполезное излучение в УФ-диапазоне, которое гасится стеклом лампы (китай не в счёт).
В связи именно с отсутствием ультрафиолетового фильтра китайские лампы убивают оптику. Будь то отражатель или покровной поликарбонат, который превращается в мелкую сеточку трещин и фары просто перестают светить.
Дальше посмотрим что нас ожидает в ближайшем будущем — светодиодные источники белого света:
Теперь в двух словах: спект излучения ксеноновых ламп близок к солнечному (общая сложенная картина), сильно дискретный, что искажает цветовую картину, но всё это слихвой окупается гораздо большим излучением, посему поездка с правильным линзованным ксеноном доставляет удовольствие в тёмное время суток без существенного напряжения зрения.
Светодиоды недотягивают в спектре лучшей различимости и светят в зоне более энергоёмкого света (синего), который легче рассеивается и вызывает ослепление (блики и рассеяное свечение именно синее). Да и LED-источники по яркости проигрывают ксенону, посему пока что ночная поездка с ними будет сопровождаться излишним напряжением глаз.
По поводу сложных условий движения — туман, как известно более длинные волны будут дальше пробираться сквозь мельчайшие капельки, а более короткие разбиваться водяной пылью на еще более короткие и тем самым создавая завесу из света, а по сему новые источники света с их большим количеством люмен оказываются практически бесполезны.
Поэтому производители до сих пор туманки делают галогеновыми, в новых же моделях и вовсе отказываются от них, отдавая предпочтение заглядывающей в повороты головной оптике. Да конечно, есть варианты экспериментирования, к примеру на Lexus LS 600h туманки выполнены линзованными ксеноновыми модулями и то скорей всего потому что головной светодиодный свет попросту недотягивает даже до ксенона в сложных условиях движения.
О том во что непосредственно выливаются спектральные картины:
Есть такое понятие как индекс цветопередачи, CRI (Color Rendering Index), это относительная величина, показывающая на сколько хорошо видны другие цвета в свете данного источника.
К примеру в синем свете будут плохо различимы объекты синего цвета, в жёлтом свете — объекты жёлтого цвета.
Так вот при сравнении сколлерированных источников света получаем следующие цифры индекса цветопередачи:
Солнце — 100,
Галоген — 97,
Ксенон 4300K — 75,
Светодиоды 5000K — 85.
Это означает что при ксеноновом источнике света мы будем хуже определять достоверный цвет предмета, но поверьте, ночью в движении это не так уж и важно. Важно видеть и видеть далеко.
Ксенон (лат. Xenonum), Xe, химический элемент VIII группы периодической системы Д. И. Менделеева, относится к инертным газам; атомный номер 54, атомная масса 131,30. На Земле Ксенон присутствует главным образом в атмосфере. Атмосферный Ксенон состоит из 9 стабильных изотопов, среди которых преобладают 129 Хе, 131 Хе и 132 Хе.
Получение:
Получают ректификацией жидкого воздуха. Хотя содержание ксенона в атмосфере крайне мало, именно воздух - практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый - потому, что почти весь ксенон возвращается в атмосферу.
Физические свойства:
Ксенон представляет собой тяжелый, редкий и пассивный газ, который при значительном охлаждении может быть переведен в жидкое и твердое состояние. Как и все инертные газы он не имеет цвета и запаха. При высоком давлении способен образовывать кристаллические гидраты. Растворяется в воде и органических растворителях. Ксенон обладает сравнительно хорошей электропроводностью.
Химические свойства:
С точки зрения химика ксенон на самом деле оказался "чужим" среди инертных газов. Он первым вступил в химическую реакцию, первым образовал устойчивое соединение. И потому сделал неуместным сам термин "инертные газы".
Мысль о том, что ксенон может образовывать устойчивые соединения с галогенами, приходила в голову многим ученым. Так, еще в 1924 г. высказывалась идея, что фториды и хлориды ксенона термодинамически вполне стабильны и могут существовать при обычных условиях. Через девять лет эту идею поддержали и развили известные теоретики - Полинг и Оддо. Изучение электронной структуры ксенона с позиций квантовой механики привело к заключению что он должен образовывать устойчивые соединения с фтором.
Однако лишь в 1961 г. Бартлетт из газообразного гексафторида платины и газообразного ксенона получает первое химическое соединение ксенона - гексафторплатинат ксенона XePtF6.
Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось. Все известные ныне соединения ксенона получены из его фторидов.
Советские химики внесли большой вклад в синтез и изучение соединений ксенона (В. А. Легасов). В соединениях проявляет степени окисления +2, +4, +6, +7.
Важнейшие соединения:
Дифторид ксенона XeF2 , летучие кристаллы, имеет резкий специфический запах. Он образуется при действии электрического разряда на смесь ксенона и четырехфтористого углерода. Очень чистый XeF2 получается, если смесь ксенона и фтора облучить ультрафиолетом. Растворимость дифторида в воде невелика, однако раствор его - сильнейший окислитель. Постепенно окисляет воду, образуя ксенон, кислород и фтористый водород; особенно быстро реакция идет в щелочной среде.
Тетрафторид ксенона XeF4 , вполне устойчивое соединение, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Кристаллическое вещество, во влажном воздухе взрывоопасен. Гидролизуется в воде с образованием оксида ксенона ХеО3. Тетрафторид ксенона фторирует ртуть:
XeF4 + 2Hg = Хе + 2HgF2.
Платина тоже фторируется этим веществом, но только растворенным во фтористом водороде.
Гексафторид ксенона XeF6 , крист. вещество, чрезвычайно активен и разлагается со взрывом. Гидролизуется с образованием оксофторидов и оксида ксенона(VI), с растворами щелочей диспропорционирует, образуя перксенаты. Он легко реагирует с фторидами щелочных металлов (кроме LiF), образуя соединения типа CsF*XeF6
Гексафторплатинат ксенона XePtF6 твердое оранжево-желтое вещество. При нагревании в вакууме XePtF6возгоняется без разложения, в воде гидролизуется, выделяя ксенон:
2XеPtF6+6H2O = 2Xe+РtO3 + 12HF
Существует также соединение Xе[PtF6]2. Аналогичные соединения ксенон образует с гексафторидами рутения, родия и плутония.
Оксид ксенона(VI) , бесцветные, расплывающиеся на воздухе кристаллы. Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Растворим, сильный окислитель.
Ксенаты соли ксеноновой кислоты - H2ХеO4, растворимы, в щелочной среде разлагаются на ксенон и перксенаты. Окислители, взрывоопасны.
Оксид ксенона(VIII) Молекула ХеО4 построена в виде тетраэдра с атомом ксенона в центре. Вещество это нестойко, при температуре выше 0°С разлагается на кислород и ксенон. Иногда разложение носит характер взрыва.
Перксенаты соли перксеноновой кислоты - H4ХеO6, кристаллич., устойчивы до 300°С, нерастворимы. Самые сильные из известных окислителей.
Применение:
В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр - от ультрафиолетового до ближней области инфракрасного. Ксеноновые лампы применяются во всех случаях, когда правильная цветопередача имеет решающее значение: при киносъемках и кинопроекции, при освещении сцены и телевизионных студий, в текстильной и лакокрасочной промышленности.
Ксеноном пользуются и медики - при рентгеноскопических обследованиях головного мозга. Как и баритовая каша, применяющаяся при просвечивании кишечника, ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден.
Радиоактивный изотоп элемента № 54, ксенон-133, используют при исследовании функциональной деятельности легких и сердца.
В виде фторидов ксенона удобно хранить и транспортировать и дефицитный ксенон, и всеразрушающий фтор. Соединения ксенона используются также как сильные окислители и фторирующие агенты.

Ксенон — элемент 18-й группы (по устаревшей классификации — элемент главной подгруппы VIII группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 54. Обозначается символом Xe (лат. Xenon ). Простое вещество ксенон — благородный одноатомный газ без цвета, вкуса и запаха.
Содержание
- 1 История
- 1.1 Происхождение названия
- 2.1 В Солнечной системе
- 2.2 Земная кора
- 4.1 Физические свойства
- 4.2 Химические свойства
- 4.3 Изотопы
![Ксенон]()
История
Открыт в 1898 году британскими учёными Уильямом Рамзаем и Морисом Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Ксенон был обнаружен как небольшая примесь к криптону. За открытие инертных газов (в частности ксенона) и определение их места в периодической таблице Менделеева Рамзай получил в 1904 году Нобелевскую премию по химии.
Происхождение названия
Рамзай предложил в качестве названия элемента древнегреческое слово ξένον , которое является формой среднего рода единственного числа от прилагательного ξένος «чужой, странный». Название связано с тем, что ксенон был обнаружен как примесь к криптону, и с тем, что его доля в атмосферном воздухе чрезвычайно мала.
Распространённость
Ксенон — весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086—0,087 см 3 ксенона.
В Солнечной системе
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли , хотя содержание изотопа 129 Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. В атмосфере Юпитера, напротив, концентрация ксенона необычно высока — почти в два раза выше, чем в фотосфере Солнца.
Земная кора
Ксенон содержится в земной атмосфере в крайне незначительных количествах, 0,087 ± 0,001 миллионной доли по объёму (мкл/л), или 1 часть на 11,5 млн. Он также встречается в газах, выделяемых водами некоторых минеральных источников. Некоторые радиоактивные изотопы ксенона, например 133 Xe и 135 Xe, получаются в результате нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии с длиной волны 467,13 нм и 462,43 нм ). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Свойства
Физические свойства
![Ксенон]()
При нормальном давлении температура плавления 161,40 К (−111,75 °C), температура кипения 165,051 К (−108,099 °C). Молярная энтальпия плавления 2,3 кДж/моль , молярная энтальпия испарения 12,7 кДж/моль , стандартная молярная энтропия 169,57 Дж/(моль·К) .
Плотность в газообразном состоянии при стандартных условиях (0 °C, 100 кПа ) 5,894 г/л (кг/м 3 ), в 4,9 раза тяжелее воздуха. Плотность жидкого ксенона при температуре кипения 2,942 г/см 3 . Плотность твёрдого ксенона 2,7 г/см 3 (при 133 К ), он образует кристаллы кубической сингонии (гранецентрированная решётка), пространственная группа Fm3m, параметры ячейки a = 0,6197 нм , Z = 4 .
Критическая температура ксенона 289,74 К (16,59 °C), критическое давление 5,84 МПа , критическая плотность 1,099 г/см 3 .
Тройная точка: температура 161,36 К (−111,79 °C), давление 81,7 кПа , плотность 3,540 г/см 3 .
В электрическом разряде светится синим цветом (462 и 467 нм). Жидкий ксенон является сцинтиллятором.
![Ксенон]()
Слабо растворим в воде (0,242 л/кг при 0 °C, 0,097 л/кг при 25 °C).
При стандартных условиях (273 К, 100 кПа): теплопроводность 5,4 мВт/(м·К) , динамическая вязкость 21 мкПа·с , коэффициент самодиффузии 4,8·10 −6 м 2 /с , коэффициент сжимаемости 0,9950, молярная теплоёмкость при постоянном давлении 20,79 Дж/(моль·К).
Ксенон диамагнитен, его магнитная восприимчивость −4,3·10 −5 . Поляризуемость 4,0·10 −3 нм 3 . Энергия ионизации 12,1298 эВ .
Химические свойства
Ксенон стал первым инертным газом, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 году. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
- Реакции со фтором:
Изотопы
Известны изотопы ксенона с массовыми числами от 108 до 147 (количество протонов 54, нейтронов от 54 до 93), и 12 ядерных изомеров.
9 изотопов встречаются в природе. Из них стабильными являются семь: 126 Xe, 128 Xe, 129 Xe, 130 Xe, 131 Xe, 132 Xe, 134 Xe. Еще два изотопа ( 124 Xe и 136 Xe) имеют огромные периоды полураспада, много больше возраста Вселенной.
Остальные изотопы искусственные, самые долгоживущие — 127 Xe (период полураспада 36,345 суток) и 133 Xe (5,2475 суток), период полураспада остальных изотопов не превышает 20 часов. Среди ядерных изомеров наиболее стабильны 131 Xe m с периодом полураспада 11,84 суток, 129 Xe m (8,88 суток) и 133 Xe m (2,19 суток).
Изотоп ксенона с массовым числом 135 (период полураспада 9,14 часа) имеет максимальное сечение захвата тепловых нейтронов среди всех известных веществ — примерно 3 миллиона барн для энергии 0,069 эВ, его накопление в ядерных реакторах в результате цепочки β-распадов ядер теллура-135 и йода-135 приводит к эффекту так называемого отравления ксеноном (см. также Иодная яма).
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
Из-за своей малой распространённости ксенон гораздо дороже более лёгких инертных газов. В 2009 году цена ксенона составляла около 20 евро за литр газообразного вещества при стандартном давлении.
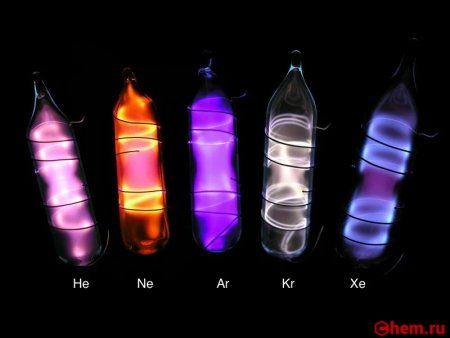
После того как были открыты гелий, неон, аргон и криптон, завершающие четыре первых периода таблицы Менделеева, уже не вызывало сомнений, что пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и не удивительно: в 1 м 3 воздуха всего лишь 0,08 мл ксенона. Рамзай совместно с Траверсом переработали около 100 т жидкого воздуха и получили 0,2 мл газа, который голубовато светился в электрическом разряде и давал своеобразный спектр с характерные спектральными линиями от оранжевой до фиолетовой области. Так был открыт новый инертный газ. Его назвали, ксеноном, что в переводе с греческого значит "чужой".
Получение:
Получают ректификацией жидкого воздуха. Хотя содержание ксенона в атмосфере крайне мало, именно воздух - практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый - потому, что почти весь ксенон возвращается в атмосферу.
Физические свойства:
Ксенон представляет собой тяжелый, редкий и пассивный газ, который при значительном охлаждении может быть переведен в жидкое и твердое состояние. Как и все инертные газы он не имеет цвета и запаха. При высоком давлении способен образовывать кристаллические гидраты. Растворяется в воде и органических растворителях. Ксенон обладает сравнительно хорошей электропроводностью.
Химические свойства:
С точки зрения химика ксенон на самом деле оказался "чужим" среди инертных газов. Он первым вступил в химическую реакцию, первым образовал устойчивое соединение. И потому сделал неуместным сам термин "инертные газы".
Мысль о том, что ксенон может образовывать устойчивые соединения с галогенами, приходила в голову многим ученым. Так, еще в 1924 г. высказывалась идея, что фториды и хлориды ксенона термодинамически вполне стабильны и могут существовать при обычных условиях. Через девять лет эту идею поддержали и развили известные теоретики - Полинг и Оддо. Изучение электронной структуры ксенона с позиций квантовой механики привело к заключению что он должен образовывать устойчивые соединения с фтором.
Однако лишь в 1961 г. Бартлетт из газообразного гексафторида платины и газообразного ксенона получает первое химическое соединение ксенона - гексафторплатинат ксенона XePtF6.
Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось. Все известные ныне соединения ксенона получены из его фторидов.
Советские химики внесли большой вклад в синтез и изучение соединений ксенона (В. А. Легасов). В соединениях проявляет степени окисления +2, +4, +6, +7.Важнейшие соединения:
Дифторид ксенона XeF2, летучие кристаллы, имеет резкий специфический запах. Он образуется при действии электрического разряда на смесь ксенона и четырехфтористого углерода. Очень чистый XeF2 получается, если смесь ксенона и фтора облучить ультрафиолетом. Растворимость дифторида в воде невелика, однако раствор его - сильнейший окислитель. Постепенно окисляет воду, образуя ксенон, кислород и фтористый водород; особенно быстро реакция идет в щелочной среде. Тетрафторид ксенона XeF4, вполне устойчивое соединение, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Кристаллическое вещество, во влажном воздухе взрывоопасен. Гидролизуется в воде с образованием оксида ксенона ХеО3. Тетрафторид ксенона фторирует ртуть:
XeF4 + 2Hg = Хе + 2HgF2.
Платина тоже фторируется этим веществом, но только растворенным во фтористом водороде.
Гексафторид ксенона XeF6, крист. вещество, чрезвычайно активен и разлагается со взрывом. Гидролизуется с образованием оксофторидов и оксида ксенона(VI), с растворами щелочей диспропорционирует, образуя перксенаты. Он легко реагирует с фторидами щелочных металлов (кроме LiF), образуя соединения типа CsF*XeF6
Гексафторплатинат ксенона XePtF6 твердое оранжево-желтое вещество. При нагревании в вакууме XePtF6 возгоняется без разложения, в воде гидролизуется, выделяя ксенон:
2XеPtF6+6H2O = 2Xe+РtO3 + 12HF
Существует также соединение Xе[PtF6]2. Аналогичные соединения ксенон образует с гексафторидами рутения, родия и плутония.
Оксид ксенона(VI) , бесцветные, расплывающиеся на воздухе кристаллы. Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Растворим, сильный окислитель.
Ксенаты соли ксеноновой кислоты - H2ХеO4, растворимы, в щелочной среде разлагаются на ксенон и перксенаты. Окислители, взрывоопасны.
Оксид ксенона(VIII) Молекула ХеО4 построена в виде тетраэдра с атомом ксенона в центре. Вещество это нестойко, при температуре выше 0°С разлагается на кислород и ксенон. Иногда разложение носит характер взрыва.
Перксенаты соли перксеноновой кислоты - H4ХеO6, кристаллич., устойчивы до 300°С, нерастворимы. Самые сильные из известных окислителей.Применение:
В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр - от ультрафиолетового до ближней области инфракрасного. Ксеноновые лампы применяются во всех случаях, когда правильная цветопередача имеет решающее значение: при киносъемках и кинопроекции, при освещении сцены и телевизионных студий, в текстильной и лакокрасочной промышленности.
Автосервис послегарантийного обслуживания
Ксеноном пользуются и медики - при рентгеноскопических обследованиях головного мозга. Как и баритовая каша, применяющаяся при просвечивании кишечника, ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден.
Радиоактивный изотоп элемента № 54, ксенон-133, используют при исследовании функциональной деятельности легких и сердца.
В виде фторидов ксенона удобно хранить и транспортировать и дефицитный ксенон, и всеразрушающий фтор. Соединения ксенона используются также как сильные окислители и фторирующие агенты.г. Новосибирск, Академгородок,
бульвар Молодежи, д. 36. корпус Б
Карта проезда- Главная |
- Установка дополнительного оборудования |
- Ксенон
Как работает ксенон?
Ксеноновая лампа представляет собой стеклянную колбу в которую закачана под большим давлением (около 30 атм. в нерабочем состоянии и 120 атм. в разогретом) смесь инертных газов (основу которой составляет тот самый ксенон) и солей металлов. В колбе находятся два электрода. Для розжига дуги между ними требуется высоковольтные импульсы напряжения (до 25000 В), затем работа лампы поддерживается при напряжении в 85 В. Дуговой разряд между электродами инициирует яркое свечение газовой смеси.
![kseon]()
Яркость источника света характеризуется цветовой температурой. Например, у Солнца цветовая температура 5000 К, у ксеноновых ламп - 4300 К, а у галогеновых всего лишь 2800 К. Спектр свечения ксеноновых ламп ближе к спектру свечения Солнца, т. е., дневному свету. Поэтому, свет ксеноновых фар имеет слегка голубоватый оттенок, а обычных галогеновых - желтоватый.
Основным плюсом ксеноновых фар перед галогеновыми является более мощное освещение при низком потреблении энергии. Такое свойство очень важно для обеспечения безопасности на дороге. Чем дальше и отчетливее водитель видит дорогу - тем меньше риск возникновения ДТП. Свет от ксеноновых ламп по спектру ближе к дневному, поэтому позволяет водителям лучше оценивать обстановку на дороге.Появляется больше времени для реакции, что очень важно при поездках ночью, когда организм человека устал.
Свет ксеноновых ламп лучше "пробивает" туман и дождь, освещая дорогу, а не капли воды в воздухе. Видимость в таких условиях намного выше, чем при использовании "галогенок". Свет "ксенона" не ослепляет водителя, в отличии от света обычных ламп, - так как имеет более высокую частоту, и лучше рассеивается.
Другой плюс ксеноновых ламп - их долговечность. Средний ресурс таких "светил" составляет до 3000 часов против 500 часов галогеновых ламп. То есть, если вы используете фары в среднем по 2 часа в сутки каждый день в году, срок службы ксеноновых ламп составит до 3-4-х лет, "галогенок" же вам хватит максимум на полгода.
Газоразрядные лампы на основе ксенона имеют меньшую потребляемую мощность - 35 Вт, галогеновые же - 55 Вт и выше. Но при этом сила света обычных ламп почти в два раза ниже - 1550 люмен против 3000 ксеноновых.
Наверняка, каждый водитель знает, как трудно оттирается грязь на фарах после длительной поездки. Происходит это потому, что лампа (и стекло) фары нагреваются, подсушивая дорожную грязь, попавшую на стекло. При потреблении мощности в 35 Вт ксеноновые лампы переводят в тепло лишь 10%, а галогеновые около 35-40% - при потреблении в 55 Вт. Поэтому при использовании ксеноновых ламп, стекло фары не будет перегреваться и лопаться при попадании на него воды, а грязь будет легче отмываться.
Повреждение стеклянной колбы;
Разгерметизация внешнего уплотнения или повышение хрупкости трубки разряда;Что такое цветовая температура?
Цветовая температура ксеноновой лампочки равная 6000 кельвинов вовсе не означает, что Ваша лампочка нагревается на поверхности до такой температуры (6000 кельвинов = 5727 градусов по цельсию). Данная величина означает, что распределение энергии в видимом спектре излучения лампочки будет соответствовать распределению энергии в видимом спектре черного тела нагретого до 6000 кельвинов.
Представим себе абсолютно чёрное тело, то есть тело, которое не отражает никакие световые лучи. Для примитивного эксперимента пусть это будет спираль из вольфрама в электрической лампочке. Соединим эту несчастную лампочку с электрической цепью через реостат (изменяемое сопротивление), выгоним всех из ванной комнаты, выключим освещение, подадим ток и будем наблюдать за цветом спирали, постепенно понижая сопротивление реостата.
В один прекрасный момент наше абсолютно чёрное тело начнёт светиться еле заметным красным цветом. Если замерить в этот момент его температуру, то окажется, что она будет примерно равна 900 градусам по Цельсию.
Поскольку все излучения происходят от скорости движения электронов, которая равна нулю при нуле градусов Кельвина (-273С), то в дальнейшем забудем про шкалу Цельсия, и будем пользоваться шкалой Кельвина. Таким образом, начало видимого излучения абсолютно чёрного тела наблюдается уже при 1200К, и соответствует красной границе спектра. То есть, попросту говоря, красному цвету соответствует цветовая температура 1200К. Продолжая нагревать нашу спираль, замеряя при этом температуру, мы увидим, что при 2000К её цвет станет оранжевым, а затем, при 3000К - жёлтым. При 3500К наша спираль перегорит, так как будет достигнута температура плавления вольфрама.Однако если бы этого не произошло, то мы увидели бы, что при достижении температуры 5500К цвет излучения был бы белым, становясь при 6000К голубоватым, и при дальнейшем нагревании вплоть до 18000К всё более голубым, что соответствует фиолетовой границе спектра. Эти цифры и назвали "цветовой температурой" излучения. Каждому цвету соответствует его цветовая температура. Психологически трудно привыкнуть к тому, что цветовая температура пламени свечи (1200К) в десять раз ниже (холоднее) цветовой температуры морозного зимнего неба (12000К). Тем не менее это так, цветовая температура отличается от обычной температуры.
800 К — начало темно-красного свечения раскаленных тел;
2000 К — свет пламени свечи;
2360 К — лампа накаливания вакуумная;
2800—2854 К — газонаполненные (газополные) лампы накаливания с вольфрамовой спиралью;
3200 К — типичные киносъемочные лампы;
5500 К — дневной свет, прямой солнечный;
6500 К — стандартный источник дневного белого света, он близок к среднедневному солнечному свету;
7500 К — дневной свет, с большой долей рассеянного от неба;
10000 К — цвет источника с «бесконечной температурой» Ксеноновые лампы имеют температуру от 4050К и выше.Максимальная яркость достигается только на температуре 4300К и с ростом или уменьшением температуры яркость падет. Однако 4300К многим не нравится из-за цвета - это яркий бело-желтый свет.Поэтому большинство предпочитает температуру 6000К яркий холодный белый свет. Яркость ниже незначительно зато красиво.
Температура выше 6000К уже мало пригодна для практического применения так как голубой(7000К) и синий(8000К) цвет по яркости не намного лучше обычных галогеновых ламп.
На графике показана зависимость мощности светового потока от цветовой температуры.
Мощность светового потока - количественная величина, показывающая, насколько интенсивен весь поток света. Мощность светового потока измеряется в люменах.
Что влияет на срок эксплуатации ксеноновых ламп?
Частое включение и выключение( при каждом новом включении частицы электродов разряжаются);
Включение горячих ламп ( происходит сгорание цветодающих примесей в лампах, последствие: изменение цвета в красноватые или зеленоватые оттенки);
Некачественные приборы для зажигания;
Неправильное место положения лампы;
Повреждение стеклянной колбы;
Разгерметизация внешнего уплотнения или повышение хрупкости трубки разряда;Меры предосторожности при обращении с ксеноновой лампой.
Поскольку система ксенон включает в себя устройства, являющиеся источником высокого напряжения, установка этих устройств сопровождается определенными опасностями. В случае необходимости установки ксенона или замены ее неисправных компонентов пользуйтесь услугами ремонтных мастерских, обладающих соответствующей квалификацией, которыми обладают специалисты автоцентра «Бэст Мастер» Не пытайтесь устанавливать систему .ксенон самостоятельно.
1.Не производить проверку работоспособности ксеноновых ламп методом включения вне корпуса осветительного прибора (фары головного света). Давление в колбе лампы около 30 атмосфер в нерабочем состоянии и около 120 атмосфер в разогретом, треснувшая лампа может нанести телесные увечья;
2.Смертельно опасное напряжение розжига ксеноновой лампы является также опсным. Не прикасайтесь к ксеноновым лампам, балластам и проводам перед и после включения и выхода на рабочий режим. В момент запуска балласт системы генерирует напряжение до 25000В и может вызвать пробой не в лампе, которая является нагрузкой, а пробить на тело, расположенное ближе к массе автомобиля чем ксеноновая лампа.
3.Включайте и выключайте фары только при необходимости. Частые включения \выключения отрицательно сказываются на сроке службы ламп и являются причиной более быстрого испарения металла электродов лампы, что в свою очередь приведет к выходу из строя балласта.
4.Если Вы обнаружили повреждения в оборудовании или его неправильную работу:
Немедленно прекратите использование оборудования и обратитесь в установочный центр. Использование поврежденного или неисправного оборудования может привести к поражению током или пожару.5.Когда свет внезапно погас.
Остановитесь в безопасном месте, выключите свет и через некоторое время повторно включите. Если это действие не исправило ситуацию, выключите свет на переключателе с повторным включением через 15 минут. Если фары включились нормально, то это означает что произошел случайный сбой, вызвавший срабатывание защиты в балласте.6.Регулировка света фар.
Яркость ксеноновых фар вдвое превышает яркость галогенных. По этой причине неправильно отрегулированные фары могут привести к ослеплению других участников движения с возникновением опасных аварийных ситуаций. Установите правильное распределение световых пучков в специализированной мастерской.Читайте также: