Соединения ксенона со степенью окисления 6
Опубликовано: 16.05.2024
Гексафторид ксенона при охлаждении до 90 К (–183 ° С) гидролизуется спокойно с образованием сначала фторидов – оксидов ксенона(VI), а затем – оксида ксенона(VI):
XeO2 F2 + H2O= XeO3 + 2HF
Оксотетрафторид ксенона XeOF4 - бесцветная жидкость, замерзающая при 245 К. Молекула имеет форму квадратной пирамиды.
С кислородом ни один из благородных газов не взаимодействует, и все известные оксиды и оксофториды ксенона получаются гидролизом со ответствующих фторидов. Наиболее спокойно протекает реакция взаимодействия дифторида ксенона с водой, но получаемый в качестве промежуточного продукта оксид ксенона(II) в чистом виде не выделен.
Оксид ксенона (VI) XeO3 – белое твердое гигроскопичное вещество, самопроизвольно взрывающееся. Молекула имеет форму тригональной пирамиды.
Вводе оксид ксенона (VI) хорошо растворяется с частичным образованием слабой кислоты H2XeO4.
Оксид ксенона (VI) XeO3 является более сильным окислителем, чем MnO2.
При диспропорционировании соединений Xe (VI) или при их окислении энергичными окислителями (например, озоном) образуются производные Xe (VIII) – перксенаты.
При взаимодействии перксенатов с безводной серной кислотой получается XeO4 - газ желтоватого цвета, медленно отщепляющий кислород уже при обычных условиях.
Молекула XeO4 имеет тетраэдрическую форму.
XeO4 проявляет кислотные свойства; реагирует с водой, нейтрализуется щелочами. В твердом состоянии XeO4 взрывается даже при –40 ° С; он является сильным окислителем.
Благородные газы подгруппы криптона также находят применение в современной технике и технологии.
Ксеноном заполняют кварцевые лампы высокого давления, являющиеся наиболее мощными источниками света.
Аргон широко используется в металлургических и химических процессах, требующих инертной атмосферы, светотехнике, электротехнике, ядерной энергетике.
Неон применяют в электровакуумной и криогенной технике.
Газообразный гелий применяется для создания инертной атмосферы в различных процессах.
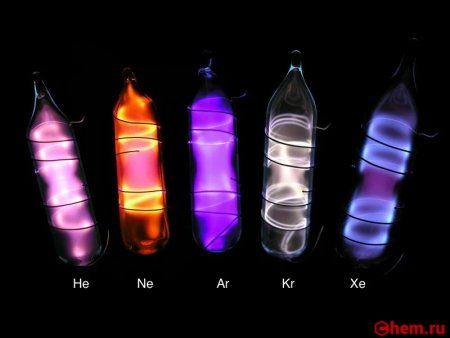
После того как были открыты гелий, неон, аргон и криптон, завершающие четыре первых периода таблицы Менделеева, уже не вызывало сомнений, что пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и не удивительно: в 1 м 3 воздуха всего лишь 0,08 мл ксенона. Рамзай совместно с Траверсом переработали около 100 т жидкого воздуха и получили 0,2 мл газа, который голубовато светился в электрическом разряде и давал своеобразный спектр с характерные спектральными линиями от оранжевой до фиолетовой области. Так был открыт новый инертный газ. Его назвали, ксеноном, что в переводе с греческого значит "чужой".
Получение:
Получают ректификацией жидкого воздуха. Хотя содержание ксенона в атмосфере крайне мало, именно воздух - практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый - потому, что почти весь ксенон возвращается в атмосферу.
Физические свойства:
Ксенон представляет собой тяжелый, редкий и пассивный газ, который при значительном охлаждении может быть переведен в жидкое и твердое состояние. Как и все инертные газы он не имеет цвета и запаха. При высоком давлении способен образовывать кристаллические гидраты. Растворяется в воде и органических растворителях. Ксенон обладает сравнительно хорошей электропроводностью.
Химические свойства:
С точки зрения химика ксенон на самом деле оказался "чужим" среди инертных газов. Он первым вступил в химическую реакцию, первым образовал устойчивое соединение. И потому сделал неуместным сам термин "инертные газы".
Мысль о том, что ксенон может образовывать устойчивые соединения с галогенами, приходила в голову многим ученым. Так, еще в 1924 г. высказывалась идея, что фториды и хлориды ксенона термодинамически вполне стабильны и могут существовать при обычных условиях. Через девять лет эту идею поддержали и развили известные теоретики - Полинг и Оддо. Изучение электронной структуры ксенона с позиций квантовой механики привело к заключению что он должен образовывать устойчивые соединения с фтором.
Однако лишь в 1961 г. Бартлетт из газообразного гексафторида платины и газообразного ксенона получает первое химическое соединение ксенона - гексафторплатинат ксенона XePtF6.
Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось. Все известные ныне соединения ксенона получены из его фторидов.
Советские химики внесли большой вклад в синтез и изучение соединений ксенона (В. А. Легасов). В соединениях проявляет степени окисления +2, +4, +6, +7.
Важнейшие соединения:
Дифторид ксенона XeF2, летучие кристаллы, имеет резкий специфический запах. Он образуется при действии электрического разряда на смесь ксенона и четырехфтористого углерода. Очень чистый XeF2 получается, если смесь ксенона и фтора облучить ультрафиолетом. Растворимость дифторида в воде невелика, однако раствор его - сильнейший окислитель. Постепенно окисляет воду, образуя ксенон, кислород и фтористый водород; особенно быстро реакция идет в щелочной среде. Тетрафторид ксенона XeF4, вполне устойчивое соединение, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Кристаллическое вещество, во влажном воздухе взрывоопасен. Гидролизуется в воде с образованием оксида ксенона ХеО3. Тетрафторид ксенона фторирует ртуть:
XeF4 + 2Hg = Хе + 2HgF2.
Платина тоже фторируется этим веществом, но только растворенным во фтористом водороде.
Гексафторид ксенона XeF6, крист. вещество, чрезвычайно активен и разлагается со взрывом. Гидролизуется с образованием оксофторидов и оксида ксенона(VI), с растворами щелочей диспропорционирует, образуя перксенаты. Он легко реагирует с фторидами щелочных металлов (кроме LiF), образуя соединения типа CsF*XeF6
Гексафторплатинат ксенона XePtF6 твердое оранжево-желтое вещество. При нагревании в вакууме XePtF6 возгоняется без разложения, в воде гидролизуется, выделяя ксенон:
2XеPtF6+6H2O = 2Xe+РtO3 + 12HF
Существует также соединение Xе[PtF6]2. Аналогичные соединения ксенон образует с гексафторидами рутения, родия и плутония.
Оксид ксенона(VI) , бесцветные, расплывающиеся на воздухе кристаллы. Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Растворим, сильный окислитель.
Ксенаты соли ксеноновой кислоты - H2ХеO4, растворимы, в щелочной среде разлагаются на ксенон и перксенаты. Окислители, взрывоопасны.
Оксид ксенона(VIII) Молекула ХеО4 построена в виде тетраэдра с атомом ксенона в центре. Вещество это нестойко, при температуре выше 0°С разлагается на кислород и ксенон. Иногда разложение носит характер взрыва.
Перксенаты соли перксеноновой кислоты - H4ХеO6, кристаллич., устойчивы до 300°С, нерастворимы. Самые сильные из известных окислителей.
Применение:
В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр - от ультрафиолетового до ближней области инфракрасного. Ксеноновые лампы применяются во всех случаях, когда правильная цветопередача имеет решающее значение: при киносъемках и кинопроекции, при освещении сцены и телевизионных студий, в текстильной и лакокрасочной промышленности.
Ксеноном пользуются и медики - при рентгеноскопических обследованиях головного мозга. Как и баритовая каша, применяющаяся при просвечивании кишечника, ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден.
Радиоактивный изотоп элемента № 54, ксенон-133, используют при исследовании функциональной деятельности легких и сердца.
В виде фторидов ксенона удобно хранить и транспортировать и дефицитный ксенон, и всеразрушающий фтор. Соединения ксенона используются также как сильные окислители и фторирующие агенты.
Ксенон (VI) оксид ( эмпирическая формула XEO 3 ) представляет собой химическое соединение с элементами ксенона и кислорода . Триоксид ксенона нестабилен и имеет тенденцию к взрывному разложению при температуре около 25 ° C. Это одно из немногих известных водорастворимых соединений благородных газов . Нестабильная ксеноновая кислота (H 2 XeO 4 ) в небольшой степени образуется в слабощелочной среде .
Оглавление
презентация
Ксенон триоксид не могут быть представлены непосредственно , поскольку электроотрицательность на кислорода недостаточно для прямой реакции. Поэтому дифторид ксенона сначала получают, позволяя ксенону реагировать с фтором под высоким давлением и высокой температурой . Затем дифторид ксенона реагирует с диспропорционированием на тетрафторид ксенона и ксенон, затем на гексафторид ксенона и дифторид ксенона. Наконец, фтор в соединении заменяется кислородом в результате превращения солями щелочных металлов и кальция с образованием промежуточных продуктов, таких как оксид тетрафторида ксенона и диоксид дифторида ксенона .
Путем реакции фторида ксенона (VI) с избытком воды и удаления образующегося фтороводорода получается относительно стабильный раствор оксида ксенона (IV), пока он остается слабокислым:
Типичные реакции триоксида ксенона
- В сильно щелочной раствор добавляется ион гидроксида (ОН - ), так что образуется HXeO 4 - . Этот HXeO 4 - постепенно диспропорционирует до перксената (Xe + VIII ) и ксенона (Xe 0 ). Затем он может перксенировать такое. Б. Изолят Na 4 XeO 6 · 6H 2 O.
- Добавляя конц. Серную кислоту (H 2 SO 4 ), газообразный, взрывоопасный ангидридтетроксид ксенона (XeO 4 ) можно получить из желтых растворов перксената (например, из Ba 2 XeO 6 ) .
- Ксенат (+ VI), здесь в форме XeO 3 , и перксенат (+ VIII) являются одними из самых сильных окислителей . (Стандартные электродные потенциалы : E 0 (Xe / XeO 3 ) = +1,8 В; E 0 (Xe / XeO 6 4− ) = +3,0 В). Они тем более интересны, что при их восстановлении создается только элементарный ксенон, который можно использовать снова и снова.
- Есть (или были в 1992 г.) признаки образования ксенатных эфиров в бурной реакции XeO 3 со спиртами.
- Когда озон (O 3 ) проходит через разбавленный раствор XeO 3 , образуются перксенаты (Xe + VIII ), которые могут образовывать стабильные соли натрия и бария.
доказательство
Растворы оксида ксенона (VI) можно исследовать количественно путем добавления йода и разбавленной хлорной или серной кислоты для количественного разложения соединения в соответствии со следующим уравнением и йодометрическим титрованием содержащегося в растворе трииодид-иона тиосульфатом .

Ксенон — элемент 18-й группы (по устаревшей классификации — элемент главной подгруппы VIII группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 54. Обозначается символом Xe (лат. Xenon ). Простое вещество ксенон — благородный одноатомный газ без цвета, вкуса и запаха.
Содержание
- 1 История
- 1.1 Происхождение названия
- 2.1 В Солнечной системе
- 2.2 Земная кора
- 4.1 Физические свойства
- 4.2 Химические свойства
- 4.3 Изотопы
![Ксенон]()
История
Открыт в 1898 году британскими учёными Уильямом Рамзаем и Морисом Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Ксенон был обнаружен как небольшая примесь к криптону. За открытие инертных газов (в частности ксенона) и определение их места в периодической таблице Менделеева Рамзай получил в 1904 году Нобелевскую премию по химии.
Происхождение названия
Рамзай предложил в качестве названия элемента древнегреческое слово ξένον , которое является формой среднего рода единственного числа от прилагательного ξένος «чужой, странный». Название связано с тем, что ксенон был обнаружен как примесь к криптону, и с тем, что его доля в атмосферном воздухе чрезвычайно мала.
Распространённость
Ксенон — весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086—0,087 см 3 ксенона.
В Солнечной системе
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли , хотя содержание изотопа 129 Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. В атмосфере Юпитера, напротив, концентрация ксенона необычно высока — почти в два раза выше, чем в фотосфере Солнца.
Земная кора
Ксенон содержится в земной атмосфере в крайне незначительных количествах, 0,087 ± 0,001 миллионной доли по объёму (мкл/л), или 1 часть на 11,5 млн. Он также встречается в газах, выделяемых водами некоторых минеральных источников. Некоторые радиоактивные изотопы ксенона, например 133 Xe и 135 Xe, получаются в результате нейтронного облучения ядерного топлива в реакторах.
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии с длиной волны 467,13 нм и 462,43 нм ). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Свойства
Физические свойства
![Ксенон]()
При нормальном давлении температура плавления 161,40 К (−111,75 °C), температура кипения 165,051 К (−108,099 °C). Молярная энтальпия плавления 2,3 кДж/моль , молярная энтальпия испарения 12,7 кДж/моль , стандартная молярная энтропия 169,57 Дж/(моль·К) .
Плотность в газообразном состоянии при стандартных условиях (0 °C, 100 кПа ) 5,894 г/л (кг/м 3 ), в 4,9 раза тяжелее воздуха. Плотность жидкого ксенона при температуре кипения 2,942 г/см 3 . Плотность твёрдого ксенона 2,7 г/см 3 (при 133 К ), он образует кристаллы кубической сингонии (гранецентрированная решётка), пространственная группа Fm3m, параметры ячейки a = 0,6197 нм , Z = 4 .
Критическая температура ксенона 289,74 К (16,59 °C), критическое давление 5,84 МПа , критическая плотность 1,099 г/см 3 .
Тройная точка: температура 161,36 К (−111,79 °C), давление 81,7 кПа , плотность 3,540 г/см 3 .
В электрическом разряде светится синим цветом (462 и 467 нм). Жидкий ксенон является сцинтиллятором.
![Ксенон]()
Слабо растворим в воде (0,242 л/кг при 0 °C, 0,097 л/кг при 25 °C).
При стандартных условиях (273 К, 100 кПа): теплопроводность 5,4 мВт/(м·К) , динамическая вязкость 21 мкПа·с , коэффициент самодиффузии 4,8·10 −6 м 2 /с , коэффициент сжимаемости 0,9950, молярная теплоёмкость при постоянном давлении 20,79 Дж/(моль·К).
Ксенон диамагнитен, его магнитная восприимчивость −4,3·10 −5 . Поляризуемость 4,0·10 −3 нм 3 . Энергия ионизации 12,1298 эВ .
Химические свойства
Ксенон стал первым инертным газом, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 году. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
- Реакции со фтором:
Изотопы
Известны изотопы ксенона с массовыми числами от 108 до 147 (количество протонов 54, нейтронов от 54 до 93), и 12 ядерных изомеров.
9 изотопов встречаются в природе. Из них стабильными являются семь: 126 Xe, 128 Xe, 129 Xe, 130 Xe, 131 Xe, 132 Xe, 134 Xe. Еще два изотопа ( 124 Xe и 136 Xe) имеют огромные периоды полураспада, много больше возраста Вселенной.
Остальные изотопы искусственные, самые долгоживущие — 127 Xe (период полураспада 36,345 суток) и 133 Xe (5,2475 суток), период полураспада остальных изотопов не превышает 20 часов. Среди ядерных изомеров наиболее стабильны 131 Xe m с периодом полураспада 11,84 суток, 129 Xe m (8,88 суток) и 133 Xe m (2,19 суток).
Изотоп ксенона с массовым числом 135 (период полураспада 9,14 часа) имеет максимальное сечение захвата тепловых нейтронов среди всех известных веществ — примерно 3 миллиона барн для энергии 0,069 эВ, его накопление в ядерных реакторах в результате цепочки β-распадов ядер теллура-135 и йода-135 приводит к эффекту так называемого отравления ксеноном (см. также Иодная яма).
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
Из-за своей малой распространённости ксенон гораздо дороже более лёгких инертных газов. В 2009 году цена ксенона составляла около 20 евро за литр газообразного вещества при стандартном давлении.
Соединения со степенями окисления +2, +4, +6. Основными соединениями, из которых получают многочисленные производные инертных газов, являются фториды. Кроме того, фториды инертных газов используются в качестве фторирующих агентов и окислителей.
Ксенон горит в атмосфере фтора ярким пламенем, состав продуктов окисления зависит от соотношения реагентов, времени и условий синтеза:
Соединение XeF2 XeF4 XeF6 Плотность, кг/м 3 4,32 4,04 - Т.пл., ºС С ростом степени окисления ксенона у соединений ослабляются основные свойства и усиливаются кислотные. Так, XeF2 является типичным основным соединением и может образовывать катионные комплексы, например:
Кроме того, XeF2 вступает в реакции обмена, образуя солеподобные соединения:
Фторид ксенона(VI) – белое кристаллическое вещество, устойчивое при комнатной температуре, чрезвычайно химически активное, например:
XeF6 проявляет амфотерные свойства. При взаимодействии с кислыми фторидами, образуются производные катионного комплекса [XeF5] + , например:
При взаимодействии с основными фторидами образуются гепта- и октафтороксенаты(VI):
Фтороксенаты цезия и рубидия устойчивы, разлагаются при температуре выше 400 ºС.
Оксофторид ксенона(VI) - XeOF4 – бесцветная жидкость, замерзающая при –28 ºС. Молекула имеет геометрию тетрагональной пирамиды:
Оксид ксенона(VI) – ХеО3 - белое, нелетучее вещество, чрезвычайно взрывчатое соединение.
Молекула оксида имеет геометрию тригональной пирамиды. Образуется в результате гидролиза фторида и оксофторида ксенона(VI):
Соединения со степенями окисления +8. Производные ксенона(VIII) – оксид XeO4 и оксофторид XeO3F2 - преимущественно кислотные соединения.
Молекула XeO4 имеет геометрию тетраэдра с атомом ксенона в центре. Оксид получают действием безводной серной кислоты на гексаоксоксенат(VIII) бария при комнатной температуре:
В обычных условиях XeO4 газ, медленно разлагается даже при температуре –40 °С:
Гексаоксоксенат(VIII)-анион (перксенат-анион - XeО6 4- ) имеет геометрию октаэдра с атомом ксенона в центре. Соли - гексаоксоксенаты(VIII) Nа4XeО6·6H2О, Nа4XeО6·8H2О, Ва2XeО6·1,5H2О – устойчивые соединения, в воде практически не растворяются.
Все соединения ксенона – сильные окислители. Так, анион XeО6 4- в кислой среде более сильный окислитель, чем перманганат-анион и фтор, Еº(XeО6 4- /Хе) = 3,0 В. С помощью соединений ксенона удалось перевести в высшую степень окисления практически все элементы. Например с помощью XeF2 получены AuF5, BrF7.
Список рекомендуемой литературы
1. Глинка Н.Л. Общая химия. Л.: Химия, 1985.
2. Общая химия / Под ред. Е.М. Соколовской и Л.С. Гузея. М.: Из-во МГУ, 1989.
3. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа, 1988.
4. Хомченко Г.П., Цитович И.К. Неорганическая химия. М.: Высшая школа, 1987.
5. Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М.: Мир, 1987.
6. Коттон Ф., Уилкинсон Дж. Основы неорганической химии. М.: Мир, 1979.
ОГЛАВЛЕНИЕ
стр. Лекция № 1 Водород………………………………………………………. …. Лекция № 2 Элементы VII-A-подгрупы (галогены)………….……. ……… Лекция № 3 Элементы VIA-подгруппы………………………….………..…. 3.1 Кислород и его соединения…………………….………. …… 3.2 Сера и ее соединения………………………………………………. …. … 3.3 Элементы подгруппы селена. …. … Лекция № 4 Элементы VA-подгруппы……………………….…………. …. …. 4.1 Азот …………………….…………………………..……………………..……. 4.2 Фосфор ……………………….………………………………………………. 4.3 Элементы подгруппы мышьяка………………………………………. …. …. Лекция № 5 Элементы IVA-подгруппы………………………………. …. 5.1 Углерод ……………………………………………………. …. 5.2 Кремний …………………………………………………………………. …. …… 5.3 Германий, олово, свинец………………………………………………. ….. Лекция № 6 Элементы IIIA-подгруппы……………………………………. …. ….. 6.1 Бор …………………….…………….………………. …. …. 6.2 Алюминий ……………………..……..…….………. …..…. 6.3 Подгруппа галлия………………………………. Лекция № 7 Элементы IIA-подгруппы…………………. …. 7.1 Бериллий ……………………………………………. …. 7.2 Магний …………………………………………………. …. 7.3 Щелочноземельные металлы. …….……………. 7.4 Элементы IA-подгруппы (щелочные металлы)………………………..…………. Лекция № 8 Общая характеристика d-элементов. Элементы IIIВ – VB подгрупп (подгруппы скандия, титана и ванадия). 8.1 Общая характеристика d-элементов………………………………. …. …. 8.2 Элементы IIIВ подгруппы (подгруппа скандия)……………………. ….…. 8.2 Элементы IVВ подгруппы (подгруппа титана)……………………. …. 8.3 Элементы VB подгруппы (подгруппа ванадия) Лекция № 9 Элементы VIВ и VII подгрупп (подгруппы хрома и марганца)…………………. 9.1 Элементы VIВ-подгруппы (подгруппа хрома)…………. …. 9.2 Элементы VIIВ-подгруппы (подгруппа марганца)……. …… Лекция № 10 Элементы VIIIB-подгруппы ……………………………. ….. 10.1 Элементы триады железа…………….……………. …. 10.2 Платиновые металлы……………………. …. …. Лекция № 11 Элементы IB- и IIB-подгрупп (подгруппы меди и цинка)…….………………………. 11.1 Элементы IB-подгруппы (подгруппа меди)…………………………. …… 11.2 Элементы IIB-подгруппы (подгруппа цинка)………………………. …. Лекция № 12 12.1 Химия f-элементов Лантаниды. 12.2 Актиниды. Лекция № 13 Инертные газы. 13.1 Гелий. Неон. Аргон. 13.2 Элементы подгруппы криптона. Список рекомендуемой литературы……………………. …… Лекции по химии элементов / Учебное пособие для студентов химических специальностей
Э.А. Гюннер, В.Ф. Шульгин, Н.С. Певзнер Редактор: Н.А. Василенко
Подписано к печати 2010 г. Формат 60x84/8 Бумага тип. ОП
Объем 4,0 п.л. Тираж: 100 экз. Заказ - № 107 Цена договорная
95007, г. Симферополь, пр. им. академика Вернадского, 4
Таврический национальный университет им. В.И. Вернадского
![]()
studopedia.org - Студопедия.Орг - 2014-2021 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.003 с) .Читайте также: